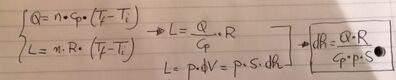Per risolvere questo problema, possiamo utilizzare la legge dei gas ideali e considerare il lavoro compiuto dal gas quando il pistone si abbassa. Il lavoro è dato da:
\[ W = P \cdot A \cdot d \]
dove:
- \( W \) è il lavoro compiuto dal gas,
- \( P \) è la pressione esterna,
- \( A \) è l'area del pistone,
- \( d \) è la variazione della posizione del pistone.
La variazione dell'energia interna del gas è data dal calore ceduto:
\[ \Delta U = Q - W \]
Dove:
- \( \Delta U \) è la variazione dell'energia interna,
- \( Q \) è il calore ceduto,
- \( W \) è il lavoro compiuto dal gas.
Nel caso di una variazione isotermica (in cui la temperatura del gas rimane costante), il calore ceduto è uguale al lavoro compiuto. Quindi:
\[ \Delta U = 0 \]
\[ Q - W = 0 \]
\[ Q = W \]
Possiamo quindi riscrivere l'equazione del lavoro come:
\[ Q = P \cdot A \cdot d \]
Ora possiamo risolvere per \( d \):
\[ d = \frac{Q}{{P \cdot A}} \]
Sostituendo i valori noti:
\[ d = \frac{2093 \, \text{J}}{{101000 \, \text{Pa} \cdot 3.14 \times 10^{-2} \, \text{m}^2}} \]
Calcolando:
\[ d \approx 0.264 \, \text{m} \]
Quindi, il pistone si abbassa di circa \(0.264 \, \text{m}\).
Dovrebbe essere corretto. Ciao!