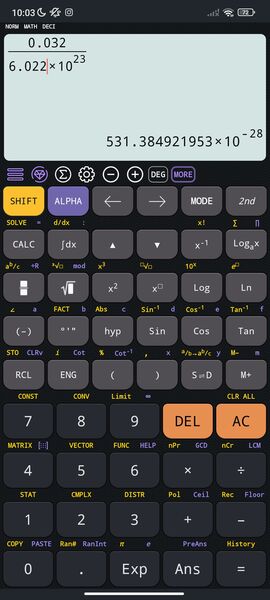
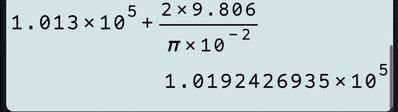Una mole di ossigeno $\left( O _2\right)$ ha massa $32 g$.
Qual è la massa di una molecola di ossigeno?
$\left[5,3 \times 10^{-2 *} kg \right]$
Su un pistone di raggio $10,0 cm$ viene posto un peso di massa 2,00 kg. La pressione dell'atmosfera è $1,01 \times 10^5 Pa$.
Quale pressione deve avere il gas dentro il cilindro per essere in equilibrio col pistone?
$$
\left[1,02 \times 10^5 Pa \right]
$$