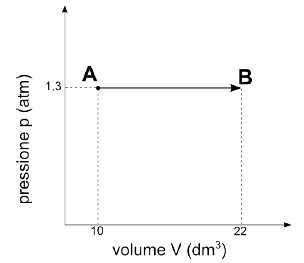
Il gas si espande a pressione costante !
Nel piano pV la trasformazione è un segmento orizzontale
Per il primo principio:
$\Delta U=Q-W$
da cui ricavi:
$Q=\Delta U+W$
Quanto valgono, lavoro(W) e variazione di energia interna ($\Delta U$) ?
Il neon è un gas monoatomico.
$W=p \Delta V=p (V_B-V_A)$
$\Delta U=\frac{3}{2}nR\Delta T$
Ma le T non le abbiamo !!
Però con l'equazione di stato...
$pV_A=nRT_A$
$T_A=\frac{pV_B}{nR}$
$pV_B=nRT_B$
$T_B=\frac{pV_B}{nR}$
$\Delta T=T_B-T_A=\frac{p}{nR}(V_B-V_A)$
sostituiamo:
$\Delta U=\frac{3}{2}nR \frac{p}{nR}(V_B-V_A)$
Ma guarda ..semplificando
$\Delta U=\frac{3}{2}p(V_B-V_A)=\frac{3}{2}W$
quindi:
$Q=\Delta U+W=\frac{3}{2}W+W$
metti i numeri e controlliamo se i conti tornato
^_^