Q1 + Q2 = 0;
T1 = 10°C; l'acqua fredda si riscalda, assorbe calore Q1 positivo;
Q1 = c * m1 * (Te - T1);
T2 = 50°C; l'acqua calda cede calore Q2 negativo;
Q2 = c * m2 * (Te - T2);
c * m1 * (Te - T1) + c * m2 * (Te - T2) = 0;
c = 4186 J/kg°C si semplifica;
poiché le masse d'acqua sono uguali, (2,0 kg), troveremo la temperatura media fra 10° e 50°.
te = (50° + 10°) / 2 = 30°.
Risolvendo l'equazione otteniamo:
m1 Te - m1 T1 + m2 Te - m2 T2 = 0;
m1 Te + m2 Te = m1 T1 + m2 T2;
Te (m1 + m2) = m1 T1 + m2 T2;
Te = (2,0 * 10° + 2,0 * 50°) / (2,0 + 2,0);
Te = 2,0 * (10° + 50°) / 4,0 = 60° / 2,0 = 30°C.
Abbiamo una massa m = 4,0 kg di acqua a 30°C.
Aggiungiamo il ghiaccio! M = 10,0 kg mi sembrano tanti....
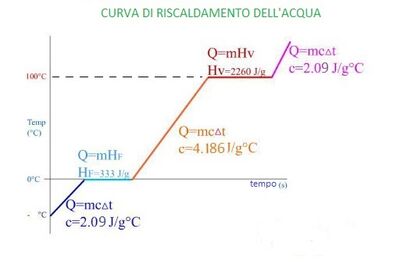
Il ghiaccio si porta a 0°C poi fonde a 0°C. Assorbe calore.
Q ghiaccio = c ghiaccio * M * [0° - (- 24°)] + Q fusione;
Q ghiaccio = 2090 * 10,0 * 24° + 3,33 * 10^5 * 10,0 = 501 600 + 33,3 * 10^5;
Q ghiaccio = 3,83 * 10^6 J; calore necessario al ghiaccio per diventare acqua a 0°.
con questo calore assorbito il ghiaccio diventa 10,0 kg di acqua fredda a 0°C.
Non c'è sufficiente calore.
c * 4,0 * (Te - 30°) + Q ghiaccio + c * 10,0 * (Te - 0°) = 0
4186 * 4,0 * Te - 4186 * 4,0 * 30° + 3,83 * 10^6 + 4186 * 10,0 * Te = 0;
58604 * Te = 502320 - 3,83 * 10^6;
58604 * Te = - 3,33 * 10^6 ; non c'è sufficiente calore per fondere il ghiaccio.
Avremo una miscela di ghiaccio fondente?
Q ceduto dall'acqua da 30° fino a 0°C:
Q1 = 4186 * 4,0 * (0° - 30°) = - 502 320 J; (4,0 kg di acqua a 0°C)
Q2 = 2090 * 10,0 * [0° - (-24°)] = + 501 600 J; (10 kg di ghiaccio a 0°C)
Q2 + Q1 = 501 600 - 502320 = - 720 J; calore residuo, ceduto dall'acqua calda che fonderà una piccola massa m di ghiaccio
Q fusione = 3,33 * 10^5 * m;
3,33 * 10^5 * m = 720 J;
m = 720/ (3,33 * 10^5) = 0,0022 kg, 2,2 grammi di ghiaccio che fonde.
Resta un blocco di ghiaccio di circa 9,998 kg e 4,002 kg di acqua, il tutto a 0°.
Sei sicuro dei 10,0 kg?
Con una massa di ghiaccio, M = 0,100 kg, e una massa d'acqua di 4,0 kg a 30°, sicuramente abbiamo la fusione del ghiaccio.
Ti rifaccio tutti i calcoli ...
Prima il ghiaccio si scalda fino a 0° poi fa il passaggio di fase e fonde a 0°, assorbe calore e diventa acqua fredda a 0°C.
Abbiamo m = 4,0 kg di acqua calda a 30°C, che cede calore al ghiaccio.
Q ghiaccio = c ghiaccio * M * [0° - (- 24°)] + Q fusione; (assorbe calore).
Q totale ghiaccio = 2090 * 0,100 * 24° + 3,33 * 10^5 * 0,100 = 5016 + 33300;
Q totale ghiaccio = + 38 316 J; calore necessario al ghiaccio per diventare acqua a 0°.
Con questo calore assorbito il ghiaccio diventa 0,100 kg di acqua fredda a 0°C. Poi si scalderà fino a T equilibrio.
c è lo stesso = 4186 J/kg°C.
c * m * (Te - 30°) + Q ghiaccio + c * M * (Te - 0°) = 0
4186 * 4,0 * (Te - 30°) + 38316 + 4186 * 0,100 * (Te - 0°) = 0;
16744 * Te - 502320 + 38316 + 418,6 + 486,6 * Te = 0;
17162,6 * Te = 502320 - 38316 - 418,6;
17162,6 * Te = 463 585;
Te = 463585 / 17162,6 = 27° C; (temperatura di equilibrio).
@giovanni22222 ciao
Di nuovo ciao. @giovanni22222