Comincia dalla legge dei gas perfetti!
P V = n R T;
Va = 40,0 dm^3 = 40,0 * 10^-3 m^3;
Ta =Pa * Va / nR;
Ta = 1,50 * 10^5 * 40,0 * 10^-3 / (3 * 8,31) = 241 k;
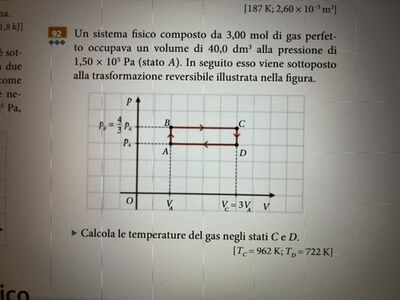
Da A a B trasformazione isovolumica: Pressione e temperatura sono proporzionali.
Pb / Pa = Tb / Ta;
Pd = 4/3 * Pa;
Tb = Pb * Ta / Pa = 4/3 * 241 = 321 K;
Da B a C trasformazione isobara, volume e temperatura sono proporzionali.
Vc / Vb = Tc / Tb;
Tc = Vc * Tb / Vb;
Vb = Va; Vc = 3 Va;
Tc = 3 Va * 321 / Va = 3 * 321 = 963 K;
Da C a D trasformazione isovolumica: Pressione e temperatura sono proporzionali.
La pressione diminuisce, diminuisce la temperatura. Pd = Pa; Pc = 4/3 Pa;
Pd / Pc = Td / Tc;
Td = Pd *Tc / Pc;
Td = Pa * 963 / (4/3 Pa) = 963 * 3/4 = 722 K.
Ciao @saaaam
https://argomentidifisica.wordpress.com/category/leggideigasperfetti/
questo è il mio sito; è facile.