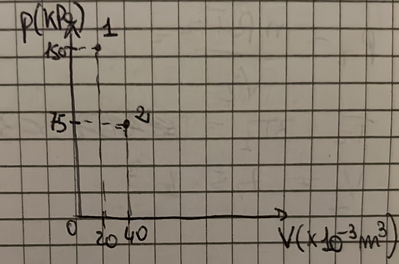
Un cilindro chiuso da un pistone mobile contiene del gas perfetto alla temperatura di $273 \mathrm{~K}$, alla pressione di $150 \mathrm{kPa}$ e con un volume di $20,0 \times 10^{-3} \mathrm{~m}^3$. Il pistone si solleva e il volume del gas raddoppia, mentre la temperatura rimane costante.
Quale valore assume la pressione?
Rappresenta in un grafico pressione-volume i due punti che rappresentano lo stato iniziale e quello finale del sistema che stiamo esaminando.
$[75,0 \mathrm{kPa}]$
problema n83