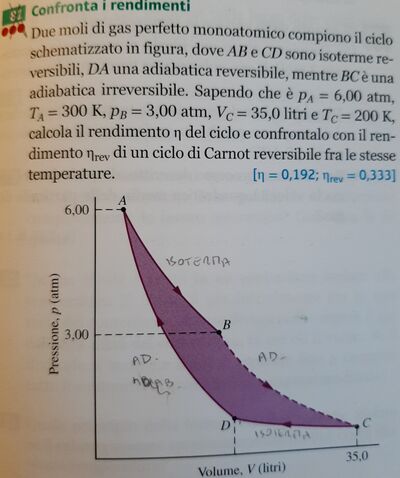
eta: rendimento η di Carnot, trasformazioni tutte reversibili:
η = (T2 - T1) / T2 = (300 - 200) / 300 = 0,333 = 33,3 %.
Nella adiabatica reversibile Q = 0 J; non varia l'entropia; se è irreversibile aumenta l'entropia, assorbe calore Q = L + DeltaU.
Usiamo litri e atmosfere: PA = 6,00 atm; Volume in litri;
R = 0,082 litri atm/molK;
VA = n R TA / PA = 2 * 0,082 * 300 / 6,00 = 8,2 litri; (VA);
PB = 3,00 atm; da A a B isoterma:
PB * VB = PA * VA;
VB = PA * VA / PB;
VB = 6,00 * 8,2 / 3,00 = 16,4 litri (VB);
R = 8,314 J/molK, per avere il lavoro in Joule.
QAB = L; nell'isoterma
L isoterma AB = n R T ln(Vb / Va);
L AB =2 * 8,314 * 300 * ln(16,4/8,2) = + 3458 J; (QAB, Q assorbito);
VC = 35,0 litri, TC = 200 K,
PC = n R TC / VC = 2 * 0,082 * 200 / 35,0 = 0,937 atm;
LBC reversibile = - DeltaU;
DeltaU = 3/2 R * 2 * (TC - TB) = - 3/2 *8,314 * 2 * (-100) = - 2494 J;
L BC reversibile = + 2494 J; lavoro se fosse reversibile;
ma BC è adiabatica irreversibile;
siamo in presenza di un’espansione ADIABATICA e IRREVERSIBILE (non è quasi—
statica). Essendo irreversibile non possiamo applicare le equazioni di Poisson…
Possiamo però utilizzare il primo principio nella forma che vale tra stati di equilibrio.
Q = L irr + (Delta U) ; (Q = 0)
L irr (da B a C) = PC * (VC - VB) = 0,937 * ( 35,0 - 16,4) = 17,43 litri*atm;
L irr = 17,43 *1,013 * 10^5 Pa * 10^-3 m^3 = 17,43 * 101,3 = 1766 J;
DeltaU = - 1766 J;
Adiabatica DA; gamma = cp/cv = 5/3;
gamma - 1 = 5/3 - 3/3 = 2/3
TA * VA^(2/3) = TD * VD^(2/3);
VD^(2/3) = TA * VA(2/3) / TD;
VD = VA * (TA/TD)^(3/2);
VD = 8,2 * (300/200) ^1,5;
VD = 8,2 * 1,5^1,5 = 8,2 * 1,837 = 15,06 litri (VD)
Da C a D isoterma, TD = TC = 200 K;
LCD = n R T ln(VD / VC)
LCD = 2 * 8,314 * 200 * ln(15,06 / 35) = - 2804 J; (Q CD ceduto);
Q assorbito= 3458 + 2494 = 5952 J
Q ceduto = 2804 + 1766 = 4570 J
η = (5952 - 4570) / 5952 = 1382 / 5952 = 0,23 = 23 %
Ho sicuramente sbagliato!
Ciao.