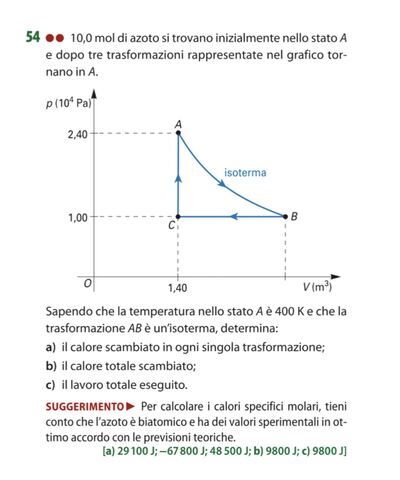
$10,0$ mol di azoto si trovano inizialmente nello stato $A$ e dopo tre trasformazioni rappresentate nel grafico tornano in $A$.
Sapendo che la temperatura nello stato $A$ è $400 K$ e che la trasformazione $A B$ è un'isoterma, determina:
a) il calore scambiato in ogni singola trasformazione;
b) il calore totale scambiato;
c) il lavoro totale eseguito.
SUGGERIMENTO $>$ Per calcolare i calori specifici molari, tieni conto che l'azoto è biatomico e ha dei valori sperimentali in ottimo accordo con le previsioni teoriche.
[a) $29100 J ;-67800 J ; 48500 J ;$ b) $9800 J ;$ c) $9800 J ]$