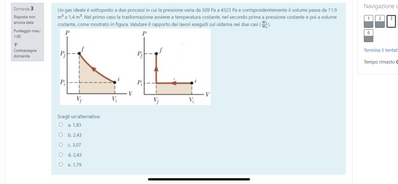
Un gas ideale è sottoposto a due processi in cui la pressione varia da 509 Pa a 4323 Pa e corrispondentemente il volume passa da 11,9 $m ^3$ a 1,4 $m ^3$. Nel primo caso la trasformazione avviene a temperatura costante, nel secondo prima a pressione costante e poi a volume costante, come mostrato in figura. Valutare il rapporto dei lavori eseguiti sul sistema nei due casi $\left(\frac{W_1}{W_2}\right)$.