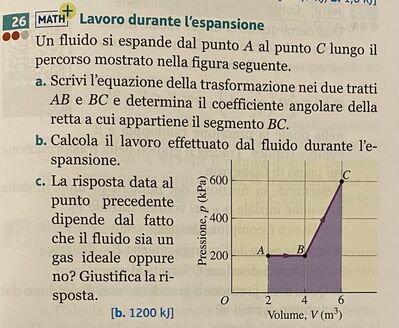
Un fluido si espande dal punto A al punto C lungo il percorso mostrato nella figura seguente.
a)Scrivi l'equazione della trasformazione nei due tratti AB e BC e determina il coefficiente angolare della retta a cui appartiene il segmento BC.
b)Calcola il lavoro effettuato dal fluido durante le-spansione.
c)La risposta data al punto precedente dipende dal fatto che il fluido sia un gas ideale oppure no? Giustifica la riposta.
come visto nell’immagine dal punto A a B la pressione è costante mentre abbiamo una variazione del volume al contrario dal punto B al punto C variano entrambi. Inoltre in una trasformazione isobara L=p deltaV potete aiutarmi? Grazie buona giornata